1
Тромбоциты – простейшие.
Авторы: Лифановский М. В., Ульман В.А.
Работа выполнялась: Домашняя лаборатория, г. Баку
Переписку вести: Ульман В.А. 238600, а/я 23, г. Славск, Калининградская область. E-mail: ulmann@baltnet.ru
Источник финансирования: личные средства.
2
The resume.
By the purpose of research was reveal an etiology of disease of L. L.À..
Septic rheumatic carditis, crossing in chronic, septic endocarditis, chronic sepsis. For ill the combined mitral fault, and on a mean third of dextral femur - metastatic abscess was derivated. Ill was sick 13 years and has deceased per 32 years from disturbance of a cerebral circulation, in a consequent metastatic abscess of a brain.
Object of research was a blood of ill L. and able-bodied, arbitrary selected, 53 donors - volunteers and animal (toy fish, rat, dog, rabbit, grapnel and chicken).
The methods of observations and analytical methods, as well as instrumentation, with rare exception, were applied generally accepted in hematoly, parasitology, microbiology and at cultivation of cells.
In all cases the increase both breeding of thrombocytes was marked, and the properties of cultures of exposed thrombocytes were identical.
For ill L. from separated metastatic abscess and from an eye, ear and nose, before mors the culture of thrombocytes was exposed only.
The thrombocytes are elementary - colonial suctorial infusorians.
They probably belong to the type of protosoa, class of infusoria, order of colonial suctorial infusoria.
Keywords
Thrombocytes, thrombosis, hemostasis, cardiovascular system, rheumatic disease, chronic sepsis, education blood, blood
Резюме.
Целью исследования было выявить этиологию заболевания Л-ой Л.А..
Септический ревмокардит, перешедший в хронический, септический эндокардит, хрониосепсис. У больной образовался сочетанный митральный порок, и на средней трети правого бедра – метастатический абсцесс. Больная болела 13 лет и скончалась в 32 года от нарушения мозгового кровообращения, вследствие метастатического абсцесса головного мозга.
Объектом исследования была кровь больной Л-ой и здоровых, произвольно выбранных, 53 доноров-добровольцев и животных (рыбок гурами, крысы, собаки, кролика, кошки и курицы).
Методы наблюдений и аналитические методы, как и аппаратура, за редким исключением, применялись общепринятые в гематологии, паразитологии, микробиологии и при культивировании клеток.
Во всех случаях отмечался рост и размножение тромбоцитов, и свойства культур выделенных тромбоцитов были идентичны.
У больной Л. из отделяемого метастатического абсцесса и из глаз, ушей и носа, перед смертью была выделена только культура тромбоцитов.
Тромбоциты являются простейшими – колониальными сосущими инфузориями.
Ключевые слова
Тромбоциты, тромбоз, гемостаз, сердечно-сосудистая система, ревматизм, хрониосепсис, кроветворение, кровь.
3
Введение
К исследованию побудило нас тяжёлое хроническое заболевание Л-ой Л.А., длившееся 13 лет. Первые признаки болезни проявились в период первой беременности. Больная скончалась в возрасте 32 лет от нарушения мозгового кровообращения, явившегося следствием метастатического абсцесса головного мозга[u1]. Септический ревмокардит, перешедший в хронический, септический эндокардит, хрониосепсис, сочетанный митральный порок, и на средней трети правого бедра – метастатический абсцесс, который прошел, после хирургического вмешательства. Лихорадка - почти ежегодно, весной и осенью по четыре месяца с температурой 38 – 400 Цельсия.
Визуальные наблюдения и фотографирование проводились с микроскопом БИОЛАМ С-1. Освещение искусственное, по Кёлеру. Использовали фотокамеру «Зенит», 16 мм кинокамеру и фотоплёнку типа «А-2» и «Фото-65». Выращивание культур проводили в термостате. Стерилизация проводилась в автоклаве, сушильном шкафу, пропусканием через миллипоровые фильтры и облучением ультрафиолетовыми лучами.
Фиксация мазков осуществлялась этиловым и метиловым спиртами, смесью Никифорова, нагреванием, парами формалина и дихлорэтана или их комбинированием.
Окраска проводилась по Романовскому – Гимзе, метиловым синим, по Лёффлеру в модификации Пешкова, по Шуренковой, по Нохту, раствором Люголя.
Наблюдения нативных препаратов велось в обычной камере Цейса и в камере, изготовленной травлением, без сетки. Покровные стекла подбирались по интерференционным кольцам.
Кровь бралась из пальца и локтевой вены в боксах: настольном и специальных комнатах, под контролем ультрафиолетового облучения, в шприц или пробирку. Место укола мылось водой с мылом и обрабатывалось бензином, спиртом разной концентрации, йодом, эфиром и хлороформом.
4
Результаты
В крови, взятой из мякоти 4 пальца левой руки больной, разведённой в изотоническом растворе (1:200) оказалось, что имелись «отличные» от эритроцитов, лейкоцитов и осевших на дно камеры, неподвижных тромбоцитов:
1) мелкие объекты, формы близкой к овальной, размером до 2х10-6 м (2мкм) находившиеся во взвешенном состоянии, быстро исчезавшие из фокальной плоскости объектива микроскопа из-за непрестанного движения;
2) палочки и цепочки толщиной до 3х10-6 м (3мкм) и длиной до 8х10-6м (8мкм) с неправильными очертаниями и явно выраженными перетяжками и оптическими неоднородностями, которые перемещались, змеевидно изгибаясь, или скользя вдоль продольной оси тела;
3) на поверхности некоторых эритроцитов были видны посторонние включения и выступы, некоторые из этих эритроцитов быстро, рывками, эпизодически двигались.
В водном растворе крови, той же концентрации, указанных выше объектов оказалось раз в 10 больше, на поверхности гемолизированных эритроцитов ясно были видны включения. В последовательно взятых каплях крови количество их было различно.
Объекты имели ту же окраску, что и эритроциты.
При первом же наблюдении обратила на себя внимание плотная цепочка из 3-4 звеньев пролетевшая в поле зрения со скоростью около 5х10-5м(50мкм) в секунду, влетевшая в лейкоцит и оставшаяся там. При сравнении с мазками крови оказалось, что это была цепочка из тромбоцитов (фото 1).
В крови взятой из локтевой вены палочковидные формы встречались редко.
В мазках крови окрашенных по Романовскому – Гимзе с фиксацией спиртами, эфиром, нагреванием, парами формалина, в толстой капле оказались те же объекты. Изредка встречались окрашенные объекты отдельно от эритроцитов. Все они плохо фиксировались на стекле, и при применении иммерсионной системы поле зрения почти полностью очищалось. На эритроцитах включения и неоднородности не были видны, выступы встречались крайне редко.
Краска плохо проникала через мембрану изучаемых клеток. 5
Мы предположили, что наблюдаемые объекты микроорганизмы. Для подтверждения этого нами была предпринята попытка культивирования их, которая удалась.
Нами был приготовлен раствор крови 1:200 в 1% растворе NaCl в воде. Раствор налили в пробирку и поместили в термостат при 370С. Через некоторое время, от 2 суток, для больной Л. в период лихорадки, до 4 и более недель, наблюдалось резкое увеличение количества клеток (тромбоцитов).
Нами был приготовлен раствор крови в 3% растворе хлористого натрия в воде (1:200) и капля раствора помещена в описанную выше камеру, которая на две недели была неподвижно укреплена на предметном столике микроскопа. Фотографирование происходящего в ней, проводилось через каждые 12 часов. Гипертонический раствор был применён для предупреждения гемолиза и создания дискомфорта для микроорганизмов.
В начале эритроциты сморщились и, наряду с обычными при этом образованьями, были видны инородные включения, чаще в виде роговидных выступов. Со временем, по мере наступления динамического равновесия, поверхность эритроцитов выравнивалась, но выступающие включения сохранялись и, впоследствии, из них вырастали образования по форме напоминающие бусы. У поражённых эритроцитов наблюдалась подвижность, отличная от тепловой. Они отрывисто колебались и, иногда, резко вздрогнув, сдвигались, как будто их что-то отталкивало от стекла. Особо выделялись роговидные эритроциты, похожие на скомканный в шар лист бумаги. Эти эритроциты эпизодически вздрагивали и внезапно приходили в интенсивное, отрывистое движение, при этом форма их менялась, и иногда становились видимыми прикреплённые к ним и распрямившиеся микроорганизмы в виде палочек или цепочек. При непрерывном наблюдении за ними, длящимся несколько часов (до 8), можно было заметить, как при очередном рывке от них отделялся микроорганизм в виде палочки или цепочки, отлетавший со скоростью до 6х10-5 м/с(60мкм). После отделения микроорганизма движение эритроцита прекращалось, и форма его становилась сравнимой с формой нормально деформированного эритроцита. От одного эритроцита могло оторваться до трёх микроорганизмов (фото 1). При добавлении раствора Люголя, описанное движение утихало, а описанное ниже развитие микроорганизмов замедлялось. При добавлении формалина активное движение прекращалось полностью, а развития микроорганизмов не наблюдалось.
В среднем через четверо суток, для здоровых доноров этот период доходил до 4 недель и более, имевшиеся на эритроцитах неоднородности стали прорастать в «бусы», составленных из кокков овальной формы, около 1х10-6 м (1мкм) в диаметре, соединённые между собой тонкими, едва различимыми перемычками длиной до 1х10-6 м (1мкм). До длины 1х10-4 м (100мкм) «бусы» вырастали редко, обычно они самопроизвольно распадались на части включавшие произвольное количество «бусинок» - кокков. Иногда кокки вырастали до 4х10-6 м (4мкм) в диаметре и более. Средняя длина нитей была около 1,5х10-5 м (15мкм). Эритроциты, к которым прикреплены микроорганизмы, истощаются, а микроорганизмы растут и размножаются. Отдельные клетки - кокки со временем растут, ядро при этом не видно. В определённый момент развития клетки, появляется оптическое уплотнение в клетке, которое через некоторое время распадается на две и более части, в теле клетки образуются, перетяжки соответствующие распаду внутреннего оптического уплотнения и клетка разделяется на несколько, соединённых между собой тонкими перемычками. В свободном состоянии это разделение происходит не всегда: клетка вырастает, появляется оптическое уплотнение, оно делится на части и исчезает, образовавшаяся длинная палочки может менять свою форму, изгибаясь или меняя своё поперечное сечение в любой своей части. После последующего роста, появляется оптическое уплотнение, но не сплошное, а повторяющее разделение, которое было перед исчезновением уплотнения. Окончательное разделение происходит чаще всего после интенсивного движения различных частей цепочки относительно друг друга с частотой до 2 Гц, чаще всего, вокруг одной перемычки. Описанное движение отмечается как для цепочек прикрепленных к эритроцитам, так и для свободных. Когда от эритроцита остаётся одна строма, цепочка начинает интенсивно двигаться, змеевидно изгибаясь, дёргая эритроцит, и отрывается от эритроцита, у последнего может остаться одна клетка. Энергия движения цепочек относительно велика. Неистощенный эритроцит, может
7
быть, сдвинут ею за доли секунды на расстояние равное удвоенному диаметру эритроцита.
Прикрепление микроорганизмов к эритроцитам, как и истощение последних, заметно в период лихорадки на любом мазке крови. Микроорганизм в виде цепочки может прикрепиться к эритроциту, одновременно несколькими звеньями.
Мембрана микроорганизмов плотная, краска проникает плохо. Высокой степени проникновения можно достичь, изъяв жиры из мембраны. Следовательно, для питательных веществ мембрана непроницаема. При наблюдении за отдельной клеткой было видно (фото 2), что она соединялась с эритроцитом посредством тонкой короткой нити и постоянно колебалась с периодом до 10 секунд. Эта активность чередовалась с периодами затишья. Эти колебания сопровождались изменением её формы: от шаровой к бобовидной и обратно. При приближении клетки к эритроциту часть её поверхности, обращенная к нему, повторяла его форму. При этом никогда не наблюдалось соприкосновение клетки с эритроцитом. Нити, прикреплённые к эритроцитам, двигались, змеевидно изгибаясь, видимая бегущая волна была ангармонической. При таком движении клетка работает как насос. Её объем меняется. Следовательно, она поглощает и выбрасывает окружающую среду. Об этом свидетельствует также то, что оптическая плотность клетки то становиться высокой, то низкой, с периодом от минуты до нескольких часов.
Поэтому мы предполагаем, что микроорганизмы имеют голозойное питание и нити, посредством которых они прикреплены к эритроцитам это присоски, входные отверстия, через которые засасывается пища.
Весной и осенью, при культивировании микроорганизмов, можно было наблюдать образование клеток содержащих внутри себя более мелкую клетку. Такие клетки часто прикреплялись к стеклу и совершали движения напоминающие движение присосавшихся пиявок в банке с водой. После этого в растворе появлялись в большом количестве одиночные, мелкие организмы шаровидной формы (бродяжки), которые интенсивно двигались. На фото 3 виден выход бродяжки из клетки.
Чтобы сделать мембрану клеток проницаемой для красок, мы применили фиксацию
8
мазков парами дихлорэтана до 900 с.
При рассмотрении мазков, фиксированных дихлорэтаном и окрашенных по Романовскому – Гимзе, оказалось, что:
1) эритроциты полностью гемолизировались,
2) исследуемые клетки хорошо окрасились,
3) они лучше приклеились к стеклу.
Клетки имели большое ядро, окрасившееся в красно-фиолетовый цвет, окружённое тонким слоем цитоплазмы голубого цвета. Нам удалось подметить картину похожую на деление ядер.
Поражённых эритроцитов оказалось много, что было подтверждено в наблюдениях за нативными препаратами. Иногда на одном эритроците было замечено до 5 клеток.
Для большей наглядности мы применяли смешанную фиксацию: 900 секунд смесью Никифорова и, после сушки, 300 секунд парами дихлорэтана. При этом хорошо были видны сохранившиеся эритроциты и на них и между ними микроорганизмы с окрашенными ядрами. Свободно встречались колонии в виде «бус», с произвольным до 9 количеством ядер и цитоплазмой имевшей перетяжки разной глубины по отношению к поперечному сечению микроорганизмов.
В нескольких случаях мы наблюдали картину, напоминавшую конъюгацию.
В тушевых препаратах капсул обнаружить не удалось.
Методом Леффлера в модификации Пешкова жгутиков обнаружить не удалось, хотя короткие выступы иногда встречались.
Непрерывные наблюдения за всеми формами тромбоцитов показали:
1) Если тромбоцит мог активно двигаться, он рос и размножался.
2) Все формы взаимно переходные.
3) Морфология зависит от условий культивирования.
4) Основная форма - кокк овальной формы, всё многообразие это колонии. Палочки это колонии, образовавшиеся при незаконченном поперечном делении тромбоцитов.
Если ориентация деления нарушена, происходит ветвление клетки, что приводит к образованию колоний произвольной формы.
9
Наблюдения, проведённые над кровью и её тромбоцитами 53 доноров-добровольцев, дали одинаковые результаты. Разница в том, что период развития культуры тромбоцитов у разных доноров разный, он может быть более 4 недель. Этот период зависит от состояния здоровья донора и от участка тела, из которого взята кровь.
Свойства культуры тромбоцитов
Определение производилось общепринятыми методами.
По Грамму культивируемые клетки окрашиваются положительно.
В клетках и растворе каталаза присутствует, аммиак выделяется, сероводород нет, индол не выделяется. Агар-агар разжижается, возможно, для получения дульцина. В клетках и в колониях имеется гемосидерин. Целлюлоза не обнаружена.
Культивируемые клетки на синтетической питательной среде и сама среда содержат холестерин. Концентрация холестерина в растворе ниже, чем в клетках до 40 раз.
Если в кровь, стабилизированную гепарином, ввести культивированные клетки или среду, в которой они культивировались, то происходит свертывание крови. Сгусток крови, образовавшийся после введения в кровь культивированных клеток и оставленный с ними, через сутки начинает растворяться, а через 3-4 суток полностью лизируется.
Добавление эфирной вытяжки из говяжьего мяса в синтетическую, питательную среду приводит к тому, что в основном развиваются клетки, имеющие грушевидную форму, размером до 5 раз больше, чем клетки, культивируемые без вытяжки. Тоже наблюдается при посеве на мясо-пептодный бульон.
При добавлении в синтетическую, питательную среду, содержащую культивированные клетки, свежей крови, клетки в считанные секунды проникают в лейкоциты. Последние расширяются и разрушаются. Это особенно хорошо заметно, если питательная среда истощена. Культура клеток сохраняется в жидкой среде 5 лет, срок наблюдения. Если мазок крови на стекле не фиксировать и поместить на хранение в воздушной среде при влажности воздуха 80-90%, то клетки будут развиваться, используя вещества, находящиеся на стекле (3 года). На твёрдой питательной среде (высохшей при влажности воздуха от 80 до 90%) культура тромбоцитов существует 15
10
лет, колонии мелкие, отдельные, количество их увеличилось в 9 раз, возможно за счёт того, что они были ранее мелкие и не видимые, а со временем разрослись.
Клетки спор и цист не образуют.
Клетки, полученные в результате культивирования на синтетической, питательной среде, выдерживались сутки в растворе дистиллированной воды. Затем помещались в раствор 0,1 моля щавелевой кислоты с углеродом 14. Через 5 минут тромбоциты были отделены центрифугированием. Выделенные клетки были промыты 3 раза в 0.9%-ном водном растворе хлористого натрия и 3 раза дистиллированной водой, посуда каждый раз менялась. Проверка
на наличие радиоактивности с помощью счётчиков показала, что она на уровне фона и зафиксировать её удалось только фотографированием. Препарат находился на алюминиевой подложке, которая помещалась на фотопластинку для радиоактивных исследований, время
экспозиции - одни сутки. Отмытые клетки были помещены в свежую, синтетическую питательную среду при 37 град С. Наблюдения показали, что по сравнению с контролем, меченые клетки первые четыре дня росли и размножались энергичнее, при этом преобладали крупные формы клеток грушевидной формы, а затем культура погибла.
Признаки для идентификации клеток
(выделены из крови человека и животных)
Особенности морфологии и цитологии
1. Форма и размеры разнообразны: кокковидная, палочковидная, имеющая полярные специализированные концы, дисковидная. Могут выпускать псевдоподии. Размеры от 0,4х10-6 до 1х10-5 м (0,4 до 10мкм).
2. Соединения клеток: клетки могут объединяться или развиваться в колонии: в виде цепочек, которые могут иметь одно или несколько разветвлений, которые могут в свою очередь ветвиться; в виде клеток любой формы, имеющих сплошную цитоплазму, в которой могут, относительно свободно, перемещаться мелкие клетки и выходить из неё.
3. Размеры колоний: цепочки могут иметь длину до 2х10-4 м (200мкм), клетки практически неограниченных размеров.
11
4. Движение активное в любом возрасте за счёт изменения размеров и формы тела клетки.
5. Жгутиков нет, могут выпускать псевдоподии, с помощью которых могут прикрепляться к эритроцитам, друг к другу и к стеклу.
6. Питание голозойное. При захватывании пищи размеры увеличиваются, при выбросе объём уменьшается. Пищеварительный аппарат – канальцевая система. Входные отверстия расположены у концов псевдоподий.
7. Имеется грануломер.
8. Цист и спор не образуют.
9. Размножение путём поперечного деления и внутриклеточного почкования.
10. Капсул не отмечено.
11. Граммположительны.
12. Жизнеспособны в 0,1 М растворе соляной кислоты.
13. Могут проникать в лейкоциты.
14. Могут развиваться в лейкоцитах, последние увеличиваются в размерах, появляется подвижность зернистая, в итоге происходит их распад или нет, с выходом клеток наружу.
15. Мембрана эластична.
16. Паразитируют на эритроцитах.
Особенности роста на плотной и в жидкой питательных средах
1.Отдельные колонии имеют размер до 5х10-3 м (5мм) в диаметре. Иногда очень мелкие, различимые в микроскоп. Форма круглая. Полупрозрачные. Поверхность блестящая, гладкая. Структура зернистая. Цвет светло – бронзовый, у молодых заметен только на просвет, они напоминают каплю воды при условии смачивания. Профиль выпуклый. Край ровный. При плотном посеве сливаются. Консистенция студенистая. В воде плохо эмульгируют. В толщу агара не развиваются.
2. При штриховом посеве видны по краям описанные выше колонии, которые сливаются в центре штриха.
3. В жидкой среде образуется равномерное помутнение, очень слабое. С возрастом
12
осаждающееся. При взбалтывании видны хлопья, которые легко разрушаются. Часто, особенно при длительном первоначальном развитии при посеве из крови, рост можно отметить только при рассматривании капли – раздавленной, висячей или высушенной.
Физиолого – биохимические признаки
1. Проверен рост на следующих углеводах и спиртах: сахароза, рамноза, дульцит, иозит, мальтоза, маннит, сорбит, ксилоза, лактоза, арабиноза, глюкоза.
2. Используют: маннит, инозит, сахарозу и дульцит.
3. Кислотность понижается.
4. Разжижают агар.
5. Образуется аммиак.
6. Индол не образуется.
7. Каталаза присутствует.
8. Сероводород не выделяется.
9. Растут на синтетической питательной среде, содержащей: гексацианоферрат (11) калия, лейцин, серин, триптофан, цистеин, гистидин, аргинин, глютаминовую кислоту, метионин, пролин, аспарагин, лизин, глютамин, аминоуксусную кислоту.
10. Содержат гемосидерин.
11. Содержат серотонин.
12. Обладают антигепариновой активностью.
13. Вызывают свёртывание крови.
14. Вызывают ретракцию кровяного сгустка.
15. Лизируют тромбы.
16. Содержат холестерин.
17. Нуждаются в кислороде.
18. Растут при температуре от 0 до 42 град С.
19. Чувствительны к радиоактивности.
20. Растут в концентрированном растворе бикарбоната натрия.
21. Растут в концентрированном растворе хлористого натрия.
13
22. Наличие животных жиров способствует росту.
23. Могут использовать животные белки.
24. Выдерживают высушивание.
25. В крови содержаться вещества, тормозящие их развитие.
26. В крови содержаться вещества, вызывающие реакцию аглюцинации.
27. Срок развития культуры из крови до 4 недель при малой концентрации крови в растворе. Он зависит от состояния здоровья донора, в период ревмоатаки сильно сокращается.
28. Активность их носит сезонный характер. Повышается осенью и весной. В эти периоды размножение происходит в основном за счёт бродяжёк.
29. Активность меняется в течение суток.
30. Чувствительны к химическим неоднородностям, перепаду электрических потенциалов, изменению освещённости, давлению. При резком изменении этих параметров происходит сокращение клеток.
Предположительно относится к царству животных, к типу простейших, к классу инфузорий, к отряду колониальные сосущие инфузории.
14
Обсуждение
По нашему мнению всё вышеизложенное не вступает в противоречие ни с одним из известных экспериментальных фактов относящимся к тромбоцитам, а только дополняет их и картина получается завершённой. Многие вопросы получают ответы.
Мегакариоцитарный путь развития стволовой клетки не противоречит тому, что тромбоцит – простейший организм: Тромбоцит активно проникает в стволовую клетку и, если условия позволяют, стволовая клетка и тромбоцит совместно развиваются. Тромбоциты растут и размножаются, а стволовая клетка превращается в урода и распадается или нет.
Из вышесказанного вытекает, что тромбоциты крови составляют ничтожное количество от тромбоцитов находящихся в организме. Тромбоциты потенциально могут развиваться везде, если для этого образовались подходящие условия, т.е. тромбоциты есть потенциальные паразиты.
15
Заключение
Тромбоциты есть простейшие. Они относятся к царству животных, типу простейших, к классу инфузорий, к отряду колониальные сосущие инфузории?
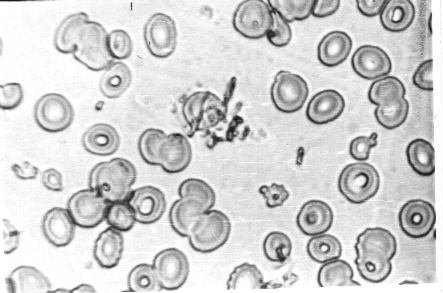
Фото 1. Мазок крови больной Л. Фиксация смесью Никифорова, окраска по Романовскому – Гимзе.. Видно прикрепление тромбоцитов к эритроцитам. Окуляр 40 (Увел. 1400 раз).
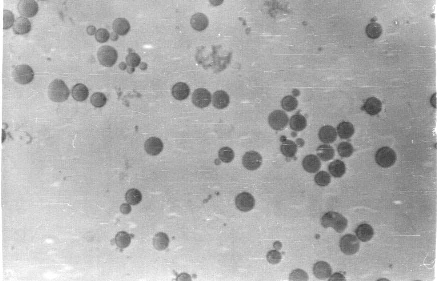
Фото 2. Нативный препарат. Кровь, разведённая 3%-ным раствором NaCl в воде (1:200) в камере. 216 часов от начала наблюдений. Видны тромбоциты до 5х10-6 м (5мкм) присосавшиеся к эритроцитам. Внизу видна присосавшаяся цепочка из двух тромбоцитов. Окуляр 40 (Увел. 1400 раз).
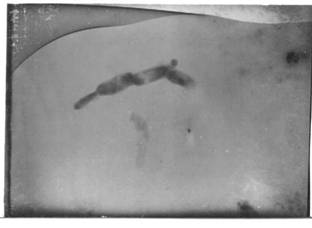
Фото 3. Тромбоциты были отмыты, помещены на формваровую плёнку и контрастированы, напылением тонкого слоя платины под углом 70 градусов. Увеличение электронного микроскопа 5000 раз, разм. 6х9х10-2 м (6х9см). Цепочка состоит из тромбоцитов разных размеров. Во втором тромбоците (слева) определяется образующаяся почка. Виден выход почки из третьего тромбоцита. У первого видны тонкие выросты, заканчивающиеся расширением. Заметна ассиметрия полюсов клеток. Тромбоциты культивированные.
17
Литература
1. Авакян А.А. Атлас анатомии простейших патогенных для человека и животных. М., Медицина, 1976.
2. Алмазов И.В., Сутулов Л.С. Атлас по гистологии и эмбриологии. М, Медицина,1978
3. Баркаган З.С. Геморрагические заболевания и синдромы. М. Медицина 1980.
4. Вепринцев Б.Н. Руководство по культивированию нервной ткани. М. Наука, 1976 г.
5. Гаврилов О.К., Козинец Г.И., Черняк Н. Б. Клетки костного мозга и периферической крови, М., Медицина, 1985.
6. Гольдберг Д.И., Гольдберг Е.Д. Справочник по гематологии, Томск, Томский университет, 1975г
7. Догель В.А Зоология беспозвоночных. М., Высшая школа, 1981
8. Звяковская И.Н. Влияние сезонов года на функциональные свойства тромбоцитов (рукопись деп. во ВНИИМИ МЗ СССР №11 859-86).
9. Кощуг Р.К., Ковпрацкий В.С. Клиническое толкование лабораторных исследований в ревматологии. Картя молдовеняскэ, Кишинев, 1974.
10. Лифановский В.А, «Способ получения тромбоцитов», патент Р.Ф. №2068265, 1992г.
11. И. Месробяну, Шт. Берчану. Иммунология, иммунохимия, иммунобиология. Академия СР. Румынии, 1977.
12. Мосягина Е. Н., Торубарова Н.А., Владимирская Е.Б. Болезни крови у детей (атлас). М., Медицина, 1981.
13. Петровский Б.В., Чазов Е. И., Андреева С.В. Актуальные проблемы гемостазиологии. М, Медицина,1981.
14. Предтеченский В.Е. Руководство по клиническим лабораторным исследованиям. М.,
18
Медгиз, 1960
15. Райков И.Б. Кариология простейших. Л., Наука, 1967.
16. Чазов Е.И., Смирнова В.Н. Стенка сосудов в атеро- и тромбогенезе. М., Медицина,1983.
17. Шиманов Н.С. О происхождении, структуре и делении кровяных пластинок. (Сб.)// Научные труды башкирского медицинского института, 1972г., т.18, стр. 270-273
18. Янковский А.В. Инфузории. Л., Наука, 1973,т. 2, вып. 1
19. Adams G. A., Swenson S. D., Rock G.: Survival and recovery of human platelets stored to five days in non-plasma medium. Blood, 1986, 67, N 3, 672-67S.
20. Anders 0., Preussner S., Konrad H.: Thrombozytensuwstitution. I. Mit-teilung: Indikation ind klinische Anwending der Thrombozytentransfusion. Z. ges inn. Med. 1986, 41, N 21, 592-595.
21. Arignani G., Paccfaiarini L., Pagliazino M.: The possible role of blood platelets in tumour growth and dissemination. Haematotogica, 1986, 71, N 3, 245—255.
22. Borber, Hugh R. K.:Immunology for the Clinician. M. Meditsina ,1980.
23. Bergey"s manual of determinative bacteriology, 8th ed.
24. Bley U.,Bossner. – Verhanlungen der Deutschen Gesellschaft fur Pataloggie.
59.Tagung/Red. von G. Dohm. Jena: VEB G. Fischer Verl.,1976, S. 465.
25. Deans J. P., Grindon A. J. Disproportionate utilization of plateletapheresis donors. Transfusion, 1986, 26, N 5, 488—489.
26.Fagiolo E., Uppa S., Mores N., Oradei A., Aureli V.: Peroxidtive events in stored platelet concentrates. Vox. Scng. 1986, 56, N 1,32—36.
27. Grignani G., Pacchiarini L., Pagliarino M.: The possible role of blood platelets in tumour growth and dissemination. Haematologica. 1986, 71, N 3, 245-255.
19
28. Herman J. H., Kamel H. T.: Platelet transfusion, current techiques remaining problems and
fiture prospects. Amer. Jpediqtr.HematoL, Oncol., 1987, 9, N 3, 272-286.
29. Heynen M. J., Blockmans D., Verwilghen R. J., Vennylen J.: Congenital macro thrombocytopenia, leucocute inclusions, deafness and proteinuria, Functional and electron microscopic observations of platelets and megakaryo-cutes. Brit. I. Haematoly, 1988,70,N 4, 441—448.
30. Hoak J. C.: Platelets and aterosclerosis. Thrombos., Hemastas. 1988, 14, N 2, 202-205.
31. Hoime S., Heaton W., Courtright M.: Platelet storage lesion in second-generation contaimers: Cotrelation with platelet ATP levels. Vox. sang 1987, 53, N 4, 214-220.
32. Lopez-Fernander M. F., Lopez-Borges C., Martin-Bernal J. A., Sancher R., Villaror L. G., Diez-JarUla J., Battle J.: Type 1IB von Willebrands disease associated with a complex trombocytopenic trombocytathy. Amer. J. Hema tol., 1988, 27, N 4, 291-298.
33. Lydany A., Kellermayer M.: Protein synthesis in human platelets. Clin. Biochem., 1988, 21, N 2, 107—110.
34. Markwardt F., Clusa E.: Beziehungen zwischen Blutpluttchen und Arteirosklerose. Abh. Akad. Wiss. DDR. Abt. Math., Natirwiss, Techn., 1981, N 1, 261-275.
35. de MENN R., Biscan M., Migne J.: Etude ultrastructurale comparec des plaguettes des la grenoville, du vean et de I"homme.Nouv. rev. franc, hematol, 1980, 22, N 3, 294-295.
36. Nachman Ralph L., Policy Margaret.: The platelet as inflammatory cell. Adv. Inflammation Res, Proc. 1st. Inf. Congs Bologna ,1978, vol I, New Jork, 1979, 169-173.
37. Nievelsteih P. F. E. M., de Grood P. G.: Interaction of blood platelets with the vessel wall. Haemostasis 1988, 18, N 4—6, 342—359.
38. Payne C. M.: Platelet satellitism an ultrastructural study. Amer. J. Pathol. 1981, 103, N 1, 116—128.
20
39. Plateletapheresis: An invaluable blood resource. Cleveland Clin. J Med., 1987, 54, N 5, 381—383.
40. Sobick B. P., Schick P.K.: Megakaryocyte biochemisty seminars. Hematol., 1986, 23, N 1, 68-87.
41. Smit Sibinga C. Th.: Platelets for transfusioncollection processing and preservation aspects. Blut, 1987, 55, N 6, 475-482.
42. Snyder E. L., Dunn B. E., Giomette C. S., Napychank P. A., Taodon N. N., Ferri P. M., Hofm ann J. P.: Protein changes occurring during storage of platelet concentrates. A two-dimensional gelelectrophoretic analisis. Transfusion, 1987, 27, N 4, 335-341.
43. Solberg C., Moen P., Little C.: Effect of centrifugation of the storage properties of platelets. Vox. Sang., 1988, 55, N 2, 97-102..
44. Stenberg P. E., levin J.: Mechanismes of platelet production. Blood cells, 1989, 15, N 1, 23-47.
45. Thomas D. P.: Overview of venous thrombogenesis. Seminars Trombos Hemostas, 1988, 14, N 1, 1-8.
46. White lames G., Clawson C. C. The surfase-connected canalicalar system of blood platelets a fenestrated membrane system. Amer. J. Pathol. 1980. 101, N 2, 353-364.
Авторы: Лифановский Михаил Валентинович-скончался
Ульман Валентин Анатольевич
238600, а/я23, г.Славск, Калининградская область, ул. Калининградская, 9-5.
Тел. 0116331764, E-mail: ulmann@baltnet.ru
[u1] Скончалась от острого нарушения мозгового кровообращения в возрасте 32 лет